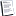
Фундаментальным аспектом эмбриональной гипотезы о происхождении рака является эпителиально-мезенхимальный переход (ЭМП) и обратный ему мезенхимально-эпителиальный переход (МЭП), которые происходят во время гаструляции эмбриона.
В процессе опухолевой прогрессии реактивация эмбриональной программы ЭМП ответственна за метастатическое распространение раковых клеток от первичной опухоли.
Ключевыми событиями в ЭМП являются:
- растворение эпителиальных межклеточных соединений;
- потеря апикально-базальной полярности и приобретение передне-задней полярности;
- реорганизация архитектуры цитоскелета и изменение формы клеток;
- снижение экспрессии генов, ответственных за эпителиальный фенотип и активация генов, которые формируют мезенхимальный фенотип, увеличение подвижности и, во многих случаях, способность к ремоделированию внеклеточного матрикса, обеспечивающая возможность инвазии клеток.
Важно отметить что, клетки, которые подвергались ЭМП, приобретают устойчивость к старению и апоптозу.
Основные шаги ЕМТ в онкологии: опухолевые клетки могут мигрировать и проникать в окружающую строму путем усиления транскрипции нескольких маркеров и генов инвазивности, таких как N-кадгерин, виментин и мезенхимальные интегрины. Затем они разлагают внеклеточный матрикс (ЕСМ) и распространяются в кровоток или в лимфатические пути. После распространения опухолевые клетки могут поражать другие органы, где они могут следовать разным судьбам, но в основном образуют растущие микрометастазы.
Агрессивный характер РПЖ обусловлен главным образом метастазированием, что облегчается десмоплазией (свойством эпителиальных тканей воспроизводить элементы соединительной ткани), специфическим микроокружением опухоли и способностью опухолевых клеток проходить EMT и принимать подвижный и инвазивный фенотип. При этом изменяется адгезия между клетками и клеточным матриксом, теряется клеточная полярность, деградируется ECM и усиливается взаимодействие клетка-строма.
Передача сигналов TGF-β играет центральную роль в развитии злокачественного состояния богатых стромой карцином, таких как рак молочной железы и аденокарцинома протоков поджелудочной железы (PDAC). TGF-β сверхэкспрессируется в опухолевой ткани и его
избыточная экспрессия коррелирует с плохим прогнозом.
Отметим, что на ранних стадиях он действует как супрессор опухолей, ингибируя клеточный цикл и способствуя апоптозу, и только на поздних стадиях он функционирует как промотор, усиливающий нестабильность генома, уклонение от иммунитета, неоангиогенез и метастазирование. Это явление было названо «парадоксом TGF-β» и тесно связана с началом программ EMT во время прогрессирования опухоли.
В нормальных условиях отделение эпителиальных и эндотелиальных клеток от ЕСМ приводит к аноикису (апоптозу зависимых от якоря клеток), а чувствительность к аноикису поддерживается белками клеточной полярности и контролируется кооперативным способом с помощью TGF-β, путей Wnt и Hippo. EMT индуцирует устойчивость опухолевых клеток к аноикису.
Активация RHO-GTPases и особенно RAC1 является ключевым шагом в механизме EMT и вероятным фактором, способствующим тубулоинтерстициальному фиброзу и MET. Так, специфичная для поджелудочной железы активация Ki-RAS ведет к ацинарно-протоковой метаплазии (ADM) и образованию предшественников PanIN. Механическая жесткость / жесткость матрикса (опухолевого) микроокружения играет решающую роль в продвижении EMT, контролируя субклеточную локализацию и передачу сигналов вниз по течению путей RAC1 и RAC1b.
Репрессия генов, кодирующих эпителиальные белки клеточных контактов, сопровождается активацией генов, продукты которых способствуют мезенхимальной адгезии. В частности, снижение экспрессии Е-кадгерина уравновешивается повышением экспрессии мезенхимального нейронального кадгерина (N-кадгерина), что ведет к "переключению кадгерина". Изменения в экспрессии генов, кодирующих цитоскелет и белковые комплексы полярности, также способствуют прохождению ЭМП.
Фактор Foxa2, являющийся антагонистом фактора Snail (SNAI1) в регуляции экспрессии гена эпителиального маркера E-кадгерина, отвечает за ингибирование ЭМП, поэтому экспрессия его гена в метастазирующей опухоли также подавляется, при этом в дифференцированных раковых клетках экспрессия Foxa2 присутствует. SOX9 в отличие от Pdx1 и FoxA2, очевидно, способствует ЭМП.
Последний раз редактировалось albert52; 26.05.2020 в 22:12..
|