|
Местный
Регистрация: 12.03.2018
Сообщений: 246
Спасибо: 0
Спасибо 6 в 5 постах
Репутация: 10
|
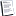
Вставка
Генный профиль развития ПЖ
Морфологические изменения, которые происходят при дифференциации поджелудочной железы от энтодермы кишечника, зависят от последовательных изменений в экспрессии генов. Внеклеточные сигналы, обеспечиваемые тканевыми взаимодействиями между развивающейся энтодермой поджелудочной железы и соседними тканями, в конечном итоге влияют на фенотип клетки, изменяя экспрессию генов в ядре.
Самыми ранними генами, избирательно экспрессируемыми в препанкреатической энтодерме, являются два фактора транскрипции, фактор гомеодомена парахокс PDX1 и фактор транскрипции основной спирали-петля-спираль (bHLH) PTF1A. Экспрессия PDX1 впервые появляется в препанкреатической энтодерме более чем за 1 день до начального формирования дорсального зачатка поджелудочной железы, и ей непосредственно предшествует появление другого парахокс-фактора, MNX1 (также известного как HB9), который в передней энтодерме экспрессируется более широко, чем PDX1. Экспрессия как MNX1, так и PDX1 сохраняется в начальных зачатках поджелудочной железы, хотя экспрессия MNX1 быстро гасится, в то время как экспрессия PDX1 еще какое-то время продолжается. В зрелых β-клетках реактивируется экспрессия обоих факторов.
Есть несколько дополнительных факторов энтодермальной транскрипции как потенциальных внутренних регуляторов экспрессии PDX1. К ним относятся такие члены семейств факторов транскрипции как HNF1 и Foxa, Onecut1, парный гомеодоменный фактор PAX6, ну и сам PDX1. HNF1a и PAX6 экспрессируются недостаточно рано или широко, чтобы инициировать раннюю экспрессию PDX1 в эмбриональном кишечнике и зачатках поджелудочной железы, но паттерны экспрессии Onecut1, HNF1b, Foxa1 и Foxa2 предполагают, что они в совокупности могут играть эту роль.
PDX1 необходим для роста зачатков поджелудочной железы; делецмя гена, кодирующего PDX1 человека, была идентифицирована у людей с агенезом поджелудочной железы. Экспрессия PTF1A следует вскоре после PDX1 и хотя он первоначально был описан как экзокринно-специфический фактор транскрипции, фактически он играет важную роль в определении судьбы всех клеток поджелудочной железы.
Поджелудочная железа состоит из трех основных типов клеток: эндокринных клеток, ацинарных клеток и протоковых клеток. Их развитие строго контролируется регуляторной сетью факторов транскрипции, которые модулируют экспрессию генов. В эту сеть включены факторы транскрипции гомеобокса (PDX1, Pbx1, HB9), факторы транскрипции гомеопротеинов парного бокса (Pax4, Pax6), факторы транскрипции Forkhead Вох (Foxa1, Foxa2) и факторы транскрипции основной спирали-петли-спирали (bHLH) (ptf1a / p48, Mist1, нейрогенин3, NeuroD).
Факторы транскрипции bHLH особенно важны для событий развития и дифференцировки из-за комбинаторной природы этих белков. Факторы bHLH подразделяются на две основные группы - белки класса A, которые включают широко экспрессируемые белки E12 / E47 / HEB, и белки класса B, которые демонстрируют ограниченный тканью паттерн экспрессии.
В большинстве случаев предпочтительный комплекс bHLH представляет собой гетеродимер, состоящий из члена класса A и члена класса B. Эти гетеродимеры связываются с сайтами E-box, обнаруженными в промоторных и энхансерных областях генов-мишеней, чтобы регулировать их транскрипцию. Из класса В ген Neurogenin3 является нижестоящей мишенью передачи сигналов Notch и необходим для развития всех клонов эндокринных клеток поджелудочной железы. NeuroD , нижестоящий ген-мишень Neurogenin3, служит ключевым регулятором транскрипции гена инсулина в β-клетках.
Ptf1a предпочтительно собирается в тримерный комплекс транскрипции PTF1 с белком E и Rbpj (или Rbpjl). Регулятор транскрипции RBPJ, иначе известный как CSL ("CBF-1, супрессор Hairless, Lag-2"), представляет собой высококонсервативный ДНК-связывающий белок, который играет центральную роль в решении судьбы клеток метазоа. RBPJ обеспечивает каноническую передачу сигналов Notch. В развитии поджелудочной железы Ptf1a незаменим для контроля роста мультипотентных клеток-предшественников, а также для спецификации и поддержания ацинарных клеток.
Как только идентичность поджелудочной железы установлена, морфогенез ветвления в MPCs (мультипотентных стволовых клетках) ведет к разделению на верхушечные и клетки ствола, предшественники ацинарных и протоковых структур соответственно. Первоначально коэкспрессируясь, Nkx6-1 становится ограниченным стволом, а Ptf1a - концевыми клетками. Последние показывают экспрессию Myc (c-Myc), тогда как клетки ствола определяются активностями генов Hnf1b, Sox9, Hnf6 и Hes1. Кроме того, расширение и поддержание экзокринного компартмента дополнительно поддерживается ингибированием пути Hippo для репрессии специфичных для эндокринной системы генов TF, включая Pax6, Ngn3, Isl1 и Nkx6-1, а также Gcg и Ins1 / 2. Активные сигналы Hippo, кстати, противодействуют активности Yap, способствуя эндокринной судьбе.
В концевых клетках Ptf1α индуцирует Nr5a2, который имеет решающее значение для ацинарной идентичности, поскольку Nr5a2 напрямую регулирует Ptf1a в петле обратной связи, а также Gata4 и Rbpjl. Эндокринный компартмент появляется в нескольких отдельных клетках внутри ствола, которые активируют Ngn3, предположительно за счет латерального ингибирования генов экзокринной дифференциации, организованного путем Notch.
Zeb1, известный EMT-TF, экспрессируется на низких уровнях в эпителиальном компартменте развивающейся поджелудочной железы. В отличие от роли Snail и Slug во время расслоения эндокринных клеток островков Лангерганса, Zeb1 является критическим для спецификации в правильных соотношениях клонов клеток в эмбриональном периоде и для тканевого гомеостаза в поджелудочной железе взрослых.
Временные волны экспрессии TF инициируют созревание эндокринных клеток, чтобы гарантировать однонаправленную спецификацию уникальных типов клеток, включая Neurod1, Insm1 и Rfx6, потеря которых ставит под угрозу идентичность и функцию островковых клеток.
Идентичность ацинарных клеток поддерживается несколькими взаимодействующими ТФ, такими как Ptf1α (см. выше) и Mist1. Подавление этих TF приводит к приобретению характеристик клеток-предшественников и увеличению образования ADM и PanIN, что подчеркивает важность поддержания экспрессии этих факторов идентичности для предотвращения инициации опухоли.
MIST1 представляет собой мастер TF, принадлежащий к семейству В белков с основной конфигурацией (доменом) спираль-петля-спираль (bHLH). MIST1 экспрессируется в серозных экзокринных клетках, включая ацинарные клетки поджелудочной железы. Вне поджелудочной железы MIST1 экспрессируется в ацинарных клетках слезных, околоушных и поднижнечелюстных слюнных желез, главных клетках желудка, альвеолярных клетках лактирующих молочных желез и секретирующих клетках, выстилающих простату и семенные пузырьки.
В поджелудочной железе MIST1 локализуется в ядрах ацинарных клеток; не наблюдается его экспрессии в протоковых или центроацинарных клетках. MIST1 является мишенью транскрипционного фактора XBP1, который также играет физиологическую роль в ацинусах поджелудочной железы. Белок MIST1 может также образовывать гетеродимеры с другими факторами транскрипции bHLH, что типично для этих белков. Однако, в отличие от других белков bHLH, MIST1, по-видимому, преимущественно работает как гомодимер.
Экзокринные клетки с выпадением гена Mist1 имеют дефект митохондриальной локализации и движения кальция, что, вероятно, является основной причиной снижения базального и регулируемого экзоцитоза, проявляемого этими клетками. При этом репрессируется Atp2c2 (ген, кодирующего секреторный путь Ca 2+АТФаза 2 (SPCA2), который участвует в поступлении кальция из клеточного депо. MIST1 также нацелен на p21 pCIP / WAF, вызывая задержку роста ацинарных клеток, что позволяет предположить, что в отсутствие MIST1 фенотип зрелых ацинарных клеток более пластичен (см. рак желудка). Также может наблюдаться спонтанный панкреатит и большая чувствительность к разным повреждающим факторам.
MIST1 также снижает способность онкогенного Kras вызывать PanIN. В эксперименте при делеции гена MIST1 KrasG12D значительно ускоряет образование PanIN, и мыши становятся нежизнеспособными из-за почти полного отсутствия ацинарной ткани, замещенной протоковым эпителием. Эти аффекты отменяются принудительным выражением MIST1. Mist1 также активирует экспрессию p21 CIP1 / WAF1 посредством уникального пути Sp1.
Последний раз редактировалось albert52; 26.09.2022 в 17:21..
|